一昨日の雪は本当に凄かった。週末だったから良かったようなものの、平日だったら通勤通学への影響も含め、もっと混乱しただろうと思いながら、週末は外出を控えブログの下準備をしていた。
さて、前回の「準備編③」において構造設備規則に記載されている内容は一通り確認した。今回は、構造設備規則に直接的な言及はないものの、当社において対応した事例を紹介する。これらの対応事項は、あくまで当社で判断して実施したものであるため、必ず必須という訳ではないが、これから医療機器製造業を取得しようと考えている企業のみなさんの参考になる事項だと思っている。
では、具体的に対応事例を紹介する。
1. 表示の重要性
突然ではあるが、人は間違いをする生き物である。私が社会人になって最初に携わった仕事である医薬品の製造においては、GMP三原則というものがあり、その一つ目に「人為的な誤りを最小限にすること」と記されている。つまり、間違わないような施策を常に講じておくことが、重要であるということを言っている。そのため、製造作業や試験作業は、それぞれの作業の詳細を手順書で管理し、その手順通り作業を行ったことを確認する記録書が必要になってくる。この内容をハード的に捉えた場合、間違いが起こらないように表示を行うことが重要と当社では考えた。
今回、当社では医療機器製造業の許可申請に際して①作業場所の表示と②設備機器の表示を行った。難しいことではないが、①では製造室、更衣室、保管室および試験検査場所(試験検査用の専用の部屋はないため、エリア表示を行った)の入口に室名表示を行った。また、製造室の入口には、現在の作業状況として製造を実施しているのか、休止しているのかが分かるように表示し、更には、入室する際に製造期間中は白衣を着用するように書かれている。これらの表示により、作業者が「この部屋(エリア)では、何の作業を行うのか、何の作業を行っているのか」が確認でき、誤った作業を行わない仕組みができている。そして②については、すべての設備機器にテプラで名称の表示を行った。
いずれの表示も「見れば分かるよ、間違える訳ないよ」と突っ込まれるぐらい簡単な内容ではあるが、冒頭に述べたように人は過ちを犯すものなのである。あまり表示を軽々しく捉えずに、必要だと思った対象物には積極的に表示することをお勧めする。



2. 不合格品の管理
構造設備規則の5項に保管管理の内容が要求されており、その中に”区分”というキーワードがある。それぞれの品目を区分して保管するのは要求事項に記載されているため、どの企業も対応していると思うが、当社では不適合品を明確に区分して保管するエリアを設けた。受入試験において不合格になった部品を誤って製造に使用しないように、更には出荷試験で不合格になっている製品を誤って出荷しないように、という対策である。具体的には、他の品目とは別に専用の扉付きの保管場所を用意し、施錠管理することで、絶対に正常品との取り違いが起こらないようにした。更に間違いが起こらないように目立つ赤色のラベルで表示を行った。(表示は重要である)
このように製造作業において不良品が発生することを防ぐことが第一であると同時に、発生した時にどのように対応すれば良いか策を講じておくことも重要である。

3. 下駄箱の設置
 3点目は上記の2点と少々風合いが異なるが、当社の川口メディカルアトリエの入口には下駄箱が設置されている。設置されている下駄箱はいわゆる学校等に設置されているタイプで上段に上履き、下段に下足が収納できるようになっており、それぞれが交差しないようにしている。
3点目は上記の2点と少々風合いが異なるが、当社の川口メディカルアトリエの入口には下駄箱が設置されている。設置されている下駄箱はいわゆる学校等に設置されているタイプで上段に上履き、下段に下足が収納できるようになっており、それぞれが交差しないようにしている。
作業所は常に衛生的に管理されるべきであることから、当社では土足での入室を禁止し、ここで専用の上履きを履いてから入室、更に前回紹介したように製造室に入る際には、粘着マットでゴミを落としてから入室する仕組みにしている。細かいことではあるが、衛生管理を一連で考えておくことは重要であり、履物に関して当社は上記のようなポリシーで運営している。ぜひ参考にしていただきたい。
ちなみに、設置している下駄箱は入口に合わせて製作したものであり、自社製作品である。弊社は医療機器の金属加工を得意としているが、設計/製作を担当する兄は、下駄箱すらも作ってしまう「ものづくり職人」であることをプチ情報として付け加えさせていただく。
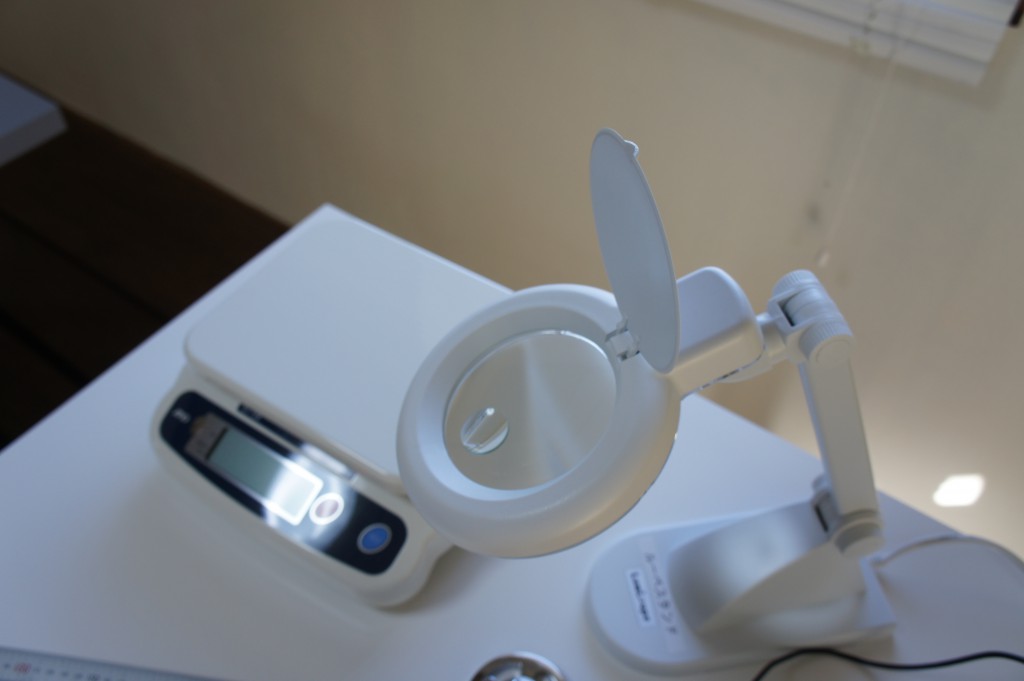
4. 計測機器の校正
 またまたガラッと話が変わるが、試験機器において、校正を行っておくことは、その試験の信頼性を担保する意味で大変重要である。当社の場合も、寸法試験に用いるノギスを校正対象としている。校正自体は外部業者に委託し、校正証明書と計器への表示を行い、有効期間を1年間として管理している。その他の計器については、直尺はJIS 1級を使用することで、定期的な校正は行っていない。また、現在は受入試験や出荷試験に用いていないため、電子天秤も校正対象外にしているが、検定付の取引証明用を使用している。(電子天秤は今後の製品において受入試験や出荷試験に使用する場合は、校正対象にする予定)
またまたガラッと話が変わるが、試験機器において、校正を行っておくことは、その試験の信頼性を担保する意味で大変重要である。当社の場合も、寸法試験に用いるノギスを校正対象としている。校正自体は外部業者に委託し、校正証明書と計器への表示を行い、有効期間を1年間として管理している。その他の計器については、直尺はJIS 1級を使用することで、定期的な校正は行っていない。また、現在は受入試験や出荷試験に用いていないため、電子天秤も校正対象外にしているが、検定付の取引証明用を使用している。(電子天秤は今後の製品において受入試験や出荷試験に使用する場合は、校正対象にする予定)
どの計器を校正対象にするべきかは、それぞれの製造品目に対する試験内容で異なるので、申請前に製造品目に対する試験検査内容を検討し、校正の対象計器を社内で確認しておいていただきたい。
以上、当社で行った対応事例の紹介である。今回までの準備編①~④をご確認いただき、まずは、医療機器製造業を申請する構想を練っていただければと思う。その内容を、資料に取りまとめ、各都道府県の薬務課へ相談に行くという流れである。
では、次回からは事前相談編として、当社が行った事前相談の内容を中心に、アポイントの取り方、相談資料の作成内容、業者コードの申請等について解説する。